Chronische inflammatoire demyeliniserende polyneuropathie (CIDP)
Landelijk protocol voor onderhoudsbehandeling intraveneus immunoglobuline (IVIg)
Auteurs: Ilse Lucke, Pieter van Doorn, Alexander Vrancken, Filip Eftimov
Kader van dit landelijk protocol
In 2021 is onder leiding van de European Academy of Neurology (EAN) en Peripheral Nerve Society (PNS) de internationale CIDP-richtlijn herzien (Van den Bergh et al. 2021). In deze richtlijn komt zowel de diagnostiek als de (inductie) behandeling van CIDP uitvoerig aan bod. Dit landelijk protocol ‘IVIg onderhoudsbehandeling bij CIDP’ is opgesteld, omdat in de internationale richtlijn de IVIg onderhoudsbehandeling bij CIDP relatief onderbelicht is en er in Nederland behoefte bestaat aan zoveel mogelijk standaardisatie van de behandeling met IVIg in CIDP. Het doel van dit protocol is om adviezen te geven over hoe IVIg naar een zo laag mogelijke dosering kan worden getitreerd en wanneer en hoe er het beste getoetst kan worden of IVIg-onderhoudsbehandeling (nog) nodig is. Dit protocol richt zich alleen op de onderhoudsbehandeling met IVIg in CIDP. Voor de diagnostiek van CIDP en eerste keus behandeling bij CIDP wordt verwezen naar de EAN/PNS richtlijn.
Dit is een protocol en geen formele NVN richtlijn. Aangezien de internationale EAN/PNS richtlijn vergelijkbare methoden hanteert als de Richtlijnen Commissie van de Nederlandse Vereniging voor Neurologie (NVN) (PICO’s, GRADE-methodologie, bijdrage patiëntorganisaties), is tevens besloten om de (Engelstalige) EAN/PNS richtlijn integraal toe te voegen aan dit landelijk protocol voor onderhoudsbehandeling met intraveneus immunoglobuline (IVIg) in CIDP door een link naar de originele publicatie (https://onlinelibrary.wiley.com/doi/epdf/10.1111/jns.12455).
Samenstelling werkgroep
Dit protocol is opgesteld door vertegenwoordigers uit de drie grootste Nederlandse CIDP centra, namelijk het Erasmus MC (Prof. dr. Pieter van Doorn), het UMC Utrecht (dr. Alexander Vrancken), het Amsterdam UMC (dr. Ilse Lucke en dr. Filip Eftimov), en vertegenwoordiger van Spierziekten Nederland (drs. Patricia Blomkwist). Pieter van Doorn en Filip Eftimov zijn tevens mede-auteurs van de EAN/PNS richtlijn.
Werkwijze
Na commentaar van het bestuur van Spierziekten Centrum Nederland zal dit protocol worden geplaatst op de sites van het Spierziekten Centrum Nederland (SCN), het CIDP-expertisecentrum. Daarnaast zal er een link op de NVN-website worden geplaatst verwijzend naar de SCN site.
Samenvatting bewijs uit literatuur
De behandeling van CIDP kan het beste worden verdeeld in inductiebehandeling en onderhoudsbehandeling. Het doel van de inductiebehandeling is verbetering, terwijl het doel van onderhoudsbehandeling voornamelijk het behoud van functie is. Inductiebehandeling met IVIg vermindert beperking in 54% van de patiënten met CIDP in de eerste 6 weken (Eftimov et al. 2013). Retrospectieve studies lieten een response op IVIg in 64-76% van de patiënten zien (Iijima et al. 2005; Kuitwaard et al. 2015). In de ICE-trial werden patiënten behandeld met een oplaaddosering van 2g/kg, gevolgd door infusen van 1g/kg elke 3 weken (Hughes et al. 2008). In de patiënten die reageerden op behandeling werd er meestal in de eerste 6 weken verbetering gemeten, maar verdere verbetering werd nog in de eerste 6 maanden gemeten (Latov et al. 2010). In ongeveer 15% van de patiënten zijn 1 of 2 inductiekuren voldoende en is er geen onderhoudstherapie nodig (Kuitwaard et al. 2015; van Doorn et al. 1991).
De effectiviteit van onderhoudsbehandeling met IVIg voor CIDP is voor het eerst aangetoond in de extensiefase van de ICE-trial in 2008 (Hughes et al. 2008). Patiënten die verbeterden op de inductiebehandeling met IVIg werden gerandomiseerd voor IVIg-onderhoudsbehandeling of een placebo voor een follow-up duur van 24 weken. Het continueren van IVIg leidde minder vaak tot achteruitgang dan placebo. Een studie in 2017 bevestigde de effectiviteit en veiligheid van IVIg als onderhoudsbehandeling voor een follow-up periode van 52 weken (Kuwabara et al. 2017). Beide studies hebben een behandelregime van 1 gram per kg lichaamsgewicht per 3 weken gebruikt. De effectiviteit van IVIg van verschillende farmaceuten verschilt zeer waarschijnlijk niet (Kuitwaard et al. 2010). De bijwerkingen die individuele patiënten kunnen ervaren kunnen wel wat verschillen tussen de diverse IVIg-merken (Kuitwaard et al. 2010; Gallia, Balducci, and Nobile-Orazio 2016).
Het vinden van de meest effectieve dosis en het optimale interval bij patiënten met CIDP is uitdagend. Duidelijke richtlijnen ontbreken. In de praktijk blijkt de benodigde totale IVIg-dosering (gram IVIg/maand) per patiënt erg te verschillen (Dyck et al. 1994; Rajabally et al. 2006). Veelal worden in zowel retrospectieve als prospectieve studies lagere doseringen van onderhoudsbehandeling gebruikt dan de dosering van 1 g/kg per 3 weken zoals in de gerandomiseerde studies werd gebruikt. In de trial is er voor een relatief hoge dosering gekozen, zodat er zo min mogelijk twijfel kan bestaan over de effectiviteit (Hughes et al. 2008; van Schaik et al. 2018). De individuele doseringsverschillen kunnen waarschijnlijk deels verklaard worden uit de verschillen in het IgG-metabolisme tussen verschillende patiënten (Kuitwaard et al. 2013), maar bewijs voor het optimaal doseren op basis van IgG-stijging ontbreekt. Ook is er geen duidelijk bewijs voor het doseren op basis van gewicht (Rajabally et al. 2013). Er zijn studies gepubliceerd die een algoritme beschrijven om een patiënt op de laagst mogelijke dosering in te stellen (Lunn et al. 2016; Kuitwaard et al. 2017). Er is gering bewijs dat het verlengen van het interval minder effectief is dan het verlagen van de dosering bij hetzelfde interval (van Doorn et al. 1991; Rajabally et al. 2006). Als er wear-off klachten zijn voorafgaand aan elk opeenvolgend infuus, kan een korter interval gekozen worden (bij dezelfde dosis per week) (Allen et al. 2018), maar waarschijnlijk leidt een ophoging van de dosis bij hetzelfde interval ook tot vermindering van de wear-off klachten.
Onlangs werd de ‘Dose response study van IVIg bij patiënten met CIDP’ (DRIP) studie afgerond waarin CIDP patiënten werden gerandomiseerd voor het lager en frequenter doseren van IVIg of voor hun huidige dosering/interval bij een gelijkblijvende totale IVIg dosis (Kuitwaard et al. 2021). Bij een gelijkblijvende totale IVIg dosering werd er geen verschil in effectiviteit gevonden tussen frequent laag doseren (meestal eens per 1-2 weken) of minder frequent (maximaal eens per 4 weken) een hoge IVIg dosering.
In de afgelopen jaren zijn de subcutane immunoglobulinen (SCIg) geïntroduceerd. In de nieuwe CIDP richtlijn werd geconcludeerd dat er onvoldoende bewijs is dat SCIg net zo geschikt is als IVIg als startbehandeling voor patiënten met CIDP.(Van den Bergh et al. 2021) Uit de PATH-trial bleek SCIg een effectieve en veilige behandeling te zijn voor CIDP in patiënten die eerder stabiel waren op IVIg (van Schaik et al. 2018). Het overzetten van IVIg op subcutane immunoglobulinen kan 1:1 gebeuren. De IVIg-dosis kan worden omgezet naar een wekelijkse dosering die, afhankelijk van de dosis, in één of meerdere keren toegediend kan worden. Doseringen tot 50 gram per week verdeeld over meerdere tijdstippen en infusieplaatsen worden in het algemeen goed verdragen (Markvardsen and Harbo 2017). In sommige patiënten zou de 1:1 omzetting niet voldoende effectief zijn en zijn er hogere doseringen nodig (Markvardsen and Harbo 2017). In patiënten met ernstige wear-off klachten of veel wisselingen door de weken heen, kan SCIg mogelijk voor een stabieler ziektebeloop zorgen. SCIg leidt tot veel minder schommelende IgG bloedconcentraties, maar er zijn vooralsnog geen klinische studies die dit bewijs hebben geleverd dat dit ook tot een stabieler ziektebeloop (Hadden and Marreno 2015).
CIDP is een ziekte met een wisselend beloop en spontane remissies kunnen hiervan onderdeel zijn. In de afgelopen jaren is uit meerdere studies gebleken dat een deel van de patiënten de onderhoudsbehandeling gestopt kan worden (Hughes et al. 2018; Hughes et al. 2008; RMC study group 2009; van Schaik et al. 2018). Helaas zijn er tot op heden geen goede biomarkers of prognostische factoren beschreven die voorspellen of de ziekte actief is. IVIg-afbouwpogingen zijn hiervoor de enige manier. Onlangs is er een trial gedaan waarin het afbouwen met een placebo werd vergeleken met het doorbehandelen met IVIg (Adrichem, manuscript nog niet gepubliceerd). Ongeveer 40% van de patiënten bleef stabiel zonder behandeling gedurende de follow-up periode van 6 maanden en 35% bleek stabiel 1 jaar na het starten van afbouw. Bij de patiënten die achteruitgang toonden werd dit in de eerste 12 weken gezien na start van de afbouw (Adrichem, manuscript nog niet gepubliceerd). De patiënten die tijdens afbouw achteruitgingen werden gerestabiliseerd met een IVIg-oplaaddosis 2 g/kg gevolgd door continueren van de onderhoudsbehandeling. Binnen 12 weken waren 94% van de deelnemers gerestabiliseerd tot hun oude niveau, waarvan de meesten verbeterden binnen 3 tot 6 weken na het oplaadinfuus.
In de IOC-trial werd afgebouwd in drie stappen, waarbij de dosis verminderd werd met 25% per infuus. In de PATH-trial werd er direct gestopt. Het is niet geheel duidelijk of direct stoppen tot een snellere, en/of ernstigere achteruitgang leidt. Mogelijk dat langzamer afbouwen wel tot een sneller herstel leidt na het herstarten van therapie (Mielke et al. 2019; Adrichem, manuscript in voorbereiding). Daarnaast blijkt in de praktijk dat patiënten zich vaak meer comfortabel voelen bij het afbouwen in plaats van direct stoppen van de behandeling.
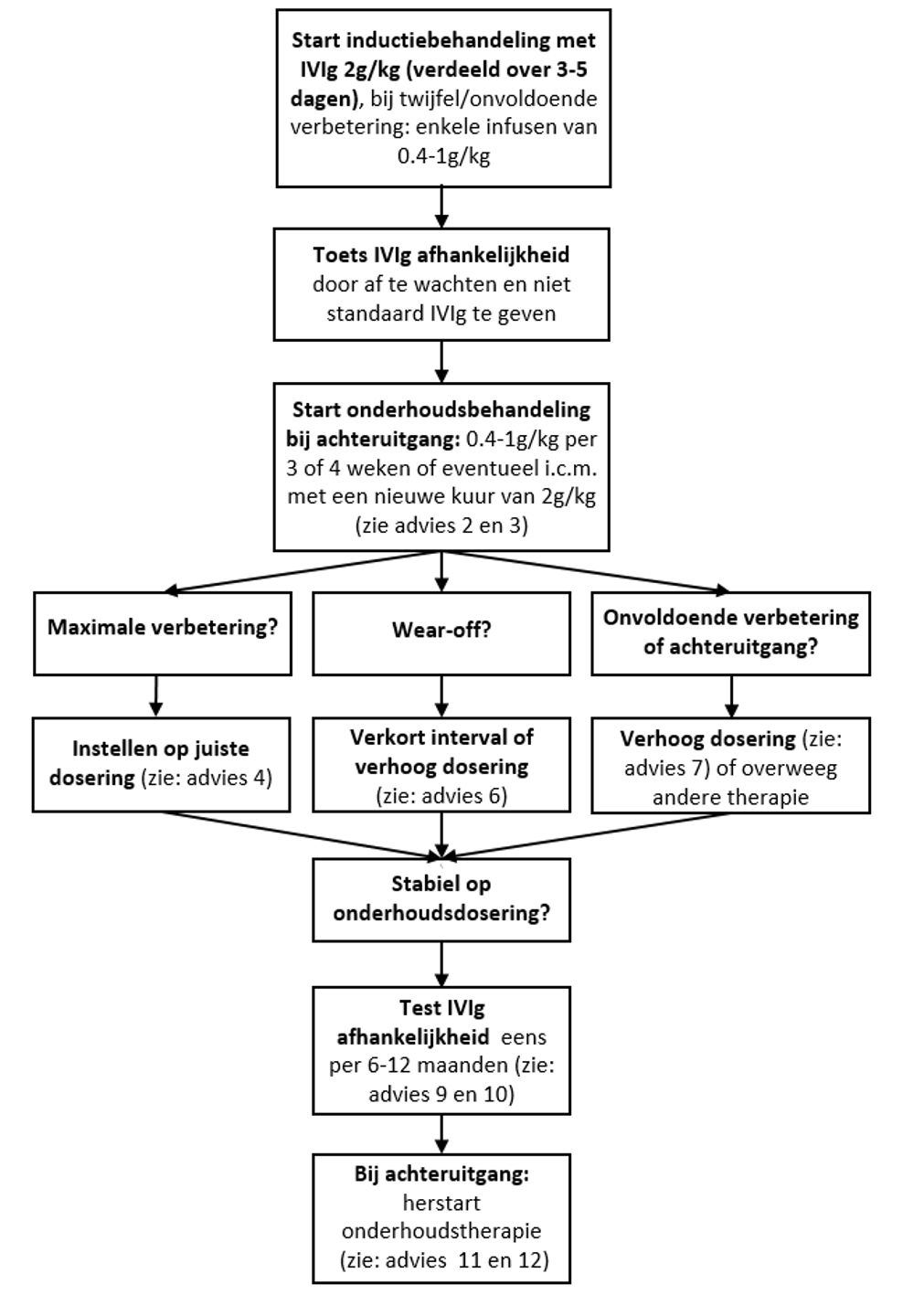
Flowchart onderhoudsbehandeling IVIg
1. Starten met onderhoudsbehandeling IVIg
De duur van inductiebehandeling is variabel. Sommige patiënten verbeteren volledig (en blijvend) na een eenmalig oplaadinfuus, maar meestal is een behandeling van tenminste meerdere maanden nodig. Bij relatief geringe klachten kan een herbeoordeling binnen 3-4 weken helpen om de beslissing voor verdere inductiebehandelingen te maken. Bij fors aangedane patiënten zullen in de regel meerdere (inductie)behandelingen nodig zijn om maximale verbetering te bewerkstellingen.
De inductiebehandeling bestaat uit een oplaadinfuus van 2g IVIg/kg (verdeeld over 3-5 dagen). Bij onvoldoende herstel na het oplaadinfuus wordt dit meestal gevolgd door enkele infusen van 0.4-1 g/kg om de (2-)3 weken. Echter, indien er drie weken na het oplaadinfuus geen tekenen van herstel worden gezien, moet allereerst de diagnose worden heroverwogen. Een van de mogelijkheden is dat de patiënt het klinisch beeld heeft wat kan passen bij een zogenaamde autoimmuun nodopathie (in dat geval kan bepaling van (para)nodale antistoffen zinvol zijn (deze bepaling is mogelijk in Erasmus Medisch Centrum). Bij enige twijfel over de diagnose adviseren we laagdrempelig overleg met een CIDP-expertise centrum. Indien de diagnose CIDP nog steeds waarschijnlijk is kan er nogmaals een infuus van 2 g/kg worden gegeven (van den Bergh et al. 2021). Als er dan nog geen verbetering wordt gezien, dan is verdere behandeling met IVIg niet geindiceerd. Als het toch om een CIDP lijkt te gaan kan worden overgestapt op behandeling met corticosteroiden, of bij ernstige uitval met plasmaferese.
Wanneer de inductiebehandeling tot een goede/maximale verbetering heeft geleid, wordt er eerst afgewacht. Pas bij achteruitgang wordt er gestart met IVIg onderhoudsbehandeling. De (totale) dosering van de IVIg onderhoudsbehandeling is 0.4-1g/kg elke 3 of 4 weken. Anderzijds kan er bij een uitgesproken achteruitgang (na aanvankelijke verbetering) zonder contra-indicaties waarschijnlijk beter een oplaadinfuus van 2g/kg (over 2-5 dagen) gevolgd door 1g/kg per 3-4 weken gestart worden. Pas als er weer een duidelijke verbetering optreedt kan er weer een poging worden gedaan om de IVIg dosering af te bouwen. In studies was de maximale IVIg dosering 80 gram per dag, omdat hoge doseringen gepaard gaan met hogere kans op trombo-embolische complicaties (Hughes et al. 2008; van Schaik et al. 2018; Abbas and Rajabally 2019; Kapoor et al. 2020). Vooral bij mensen met overgewicht of verhoogd risico op complicaties bij IVIg (zoals cardiovasculaire voorgeschiedenis, nierfalen) wordt geadviseerd om lagere IVIg doseringen na te streven. Bij overgewicht of relevante co-morbiditeit moet daarom laagdrempelig de onderhoudsbehandeling over 2 dagen worden verdeeld (bijvoorbeeld 40 gram per dag gedurende 2 dagen)
Adviezen:
1. Toets na inductiebehandeling (variabele duur) of er sprake is van IVIg-afhankelijkheid voordat er gestart wordt met onderhoudsbehandeling. De inductiebehandeling kan direct worden gestopt (zonder afbouw).
2. Bij achteruitgang na inductiebehandeling: start met IVIg-onderhoudsbehandeling.
3. Startdosering van de onderhoudsbehandeling is variabel, waarbij 0.4-1g/kg per 3 weken voor de meeste patiënten voldoende is.Bij een ernstige achteruitgang na de inductiebehandeling: geef eerst een volledige oplaadkuur geadviseerd (2 g/kg) en start aansluitend onderhoudsbehandeling.
2. Vinden van de juiste dosering IVIg bij patiënten bij wie onderhoudsbehandeling nodig blijkt
Op basis van de literatuur en de huidige internationale EAN/PNS-richtlijn wordt geadviseerd om individueel te titreren naar de laagst mogelijke dosering waarbij er geen functieverlies optreedt (Van den Bergh et al. 2021). Er is geen bewijs hoe dit het beste kan worden gedaan. Bij patiënten die overgezet worden op SCIg, kan in eerste instantie de dosis 1:1 overgezet worden naar een wekelijkse dosering. Deze behandeling geeft patiënten meer autonomie en kan onder andere een voordeel zijn voor ambulante patiënten en patiënten die veel reizen. Ook kan het overwogen worden bij patiënten die functionele achteruitgang ervaren aan het einde van het IVIg interval (wear-off klachten). De conversiefactor van IVIg naar SCIg voor de behandeling met IVIg is echter niet goed bekend.
Adviezen:
4. Indien er geen verdere verbetering meer wordt verwacht bij een stabiele patiënt (die geen duidelijke end of dose klachten heeft), verlaag de dosis en/of verleng het interval, waarbij in eerste instantie de voorkeur uitgaat naar dosisverlaging. Als toch gekozen wordt voor verlenging van het interval, dan is een interval langer dan 4 weken af te raden aangezien de halfwaardetijd van IVIg bij de meeste patiënten rond de 3 liggen. Omdat de meeste patiënten een achteruitgang ervaren in de eerste 2-3 maanden na de start van de afbouw, is het advies om in stappen te verlagen, bv met stappen van 25% bij elk infuus (expert opinie). In overleg met patiënt kan een snellere of langzamere afbouw worden afgesproken. De meeste patiënten die IVIg-afhankelijk zijn, hebben een onderhoudsbehandeling nodig van (omgerekend) minimaal 10 g per week. Er zijn echter patiënten bij wie lagere doseringen voldoende kunnen zijn.
5. Bij het omzetten van IVIg naar SCIg kan de IVIg-dosis omgerekend worden naar een wekelijkse dosis (bijv. IVIg 45g/3 weken = SCIg 15g/week) Mocht dit niet voldoende zijn, dan kan de SCIg-dosis verhoogd worden met 10-20% per gift.
6. Bij wear-off klachten die tot functionele achteruitgang en/of veel hinder met beperkingen leiden kan zowel het interval van het infuus worden verlaagd of kan de dosis worden opgehoogd. Bij lange intervallen (4 weken of meer) kan waarschijnlijk het beste eerst het interval worden verkort. Als er al een kort interval is (bv eens per 2 weken), is het advies om de dosis op te hogen (bv met 20%). Een alternatief is om patiënten om te zetten naar SCIg.
7. Bij een achteruitgang (zonder wear-off klachten) is het advies om de dosis op te hogen, bijvoorbeeld met 20-30%. Een volledige oplaaddosis (2g/kg) is meestal niet nodig. In het geval van ernstige achteruitgang kan er wel een oplaaddosis of een extra gift IVIg gegeven worden.
3. Toetsen van IVIg afhankelijkheid
Bij afwezigheid van biomarkers van ziekteactiviteit is het afbouwen en stoppen van IVIg onderhoudsbehandeling de enige manier om IVIg afhankelijkheid aan te tonen. Het is onduidelijk hoe vaak de IVIg afhankelijkheid getoetst dient te worden. In de nieuwe CIDP richtlijn wordt aangegeven om in de eerste 2-3 jaar elke 6 tot 12 maanden IVIg afhankelijkheid te toetsen en daarna elke 1-2 jaar (Van den Bergh, 2021).
Daarbij kan gekozen om direct te stoppen of af te bouwen, bijvoorbeeld in stappen van 25% per infuus of afbouw met langzamere reductie van dosis (zie advies 4). Het ideale afbouwschema is niet bekend, maar afbouwen (in plaats van direct stoppen) wordt vaak door patiënten als veiliger/prettiger ervaren. Bij gebrek aan bewijs zal de keus voor het afbouwschema van verschillende factoren afhangen, zoals eerdere afbouwervaringen bij patiënt (snelheid en ernst van achteruitgang), verwachtingen en terughoudendheid bij de patiënt, eventuele bijwerkingen, etc.
Adviezen:
8. Bespreek gelijk bij het starten van IVIg-behandeling dat de noodzaak van behandeling (IVIg-afhankelijkheid) in de toekomst regelmatig getoetst zal worden. Recente literatuur heeft uitgewezen dat er door IVIg een iets verhoogde kans is op cardiovasculair complicaties, vooral bij mensen die al cardiovasculaire risicofactoren hebben (Kapoor 2020). Dit is een extra reden is om de noodzaak voor onderhoudsbehandeling te toetsen.
9. Toets eens per 6 tot 12 maanden IVIg-afhankelijkheid gedurende de eerste 3 jaar na start van onderhoudsbehandeling. Bij herhaaldelijk aangetoonde afhankelijkheid kan worden overwogen om minder vaak te toetsten, bv elke 1-2 jaar.
10. De manier van toetsen van IVIg-afhankelijkheid vindt plaats in overleg met patiënt. Voorkeur gaat uit naar stappen van 25% dosisreductie per infuus, maar langzamer afbouw of direct stoppen is ook mogelijk. Bespreek met patiënt dat er ook (subjectieve) fluctuaties van de ziekte en symptomen tijdens het afbouwen kunnen optreden, die niet altijd uiting zijn van actieve ziekte (IOC studie). Hoe langer de afbouw duurt, hoe groter de kans is dat deze natuurlijke fluctuaties plaatsvinden.
11. Herstart IVIg alleen bij objectiveerbare achteruitgang. Deze achteruitgang kan gemeten worden met de MRC sum score, de knijpkracht (Vigorimeter) of de Inflammatory Rasch Overal Disability Scale (I-RODS). Geringe (niet objectiveerbare) fluctuaties of toename van sensibele klachten zoals tintelingen, of pijn worden ook gezien in patiënten die met IVIg worden behandeld (IOC studie). Bij twijfel over toename van ziekteactiviteit wordt op korte termijn een herhaalde beoordeling geadviseerd om eventuele achteruitgang te objectiveren.
12. Herstart onderhoudsbehandeling (i.h.a. in de dosering vóór starten van afbouw) bij achteruitgang tijdens het afbouwen of na het staken van IVIg. Afhankelijk van de ernst van achteruitgang en de aanvankelijke onderhoudsdosering kan er ook voor worden gekozen om eenmalig een hogere dosering te geven (bv een 1 g/kg of een oplaaddosering van 2 g/kg). Na een oplaaddosering 2 g/kg zijn de meeste patiënten hersteld tot hun oude niveau binnen 6 weken, maar er zijn aanwijzingen dat ook lagere doseringen tot snel herstel leiden (Adrichem, manuscript in preparation).
Belangenoverzicht
Ilse Lucke heeft geen belangenverstregeling.
PA van Doorn heeft honoraria en consultancy fees ontvangen* van Annexion, Argenx, Hansa, Immunic, Kedrion, Octapharma, Roche en Sanofi. Hij heeft research support ontvangen van Takeda, Grifols, Sanquin Blood supply, het Prinses Beatrix Spierfonds en ZonMw. *Alle honoraria en consultancy fees zijn door het Erasmus MC ontvangen ten behoeve van onderzoeksdoeleinden.
Filip Eftimov heeft honoraria en consultancy fees ontvangen van UCB pharma en CSL Behring. Hij heeft research support ontvangen van Prinses Beatrix Spierfonds, ZonMw. Als hoofdonderzoeker van INCbase (internationale CIDP Registry) heeft hij onderzoeksgeld gekregen van CSL Behring, Grifols, Takeda, Kedrion, Terumo BCT en GBS/CIDP Foundation. Alle honoraria en consultancy fees zijn door Amsterdam UMC ontvangen ten behoeve van onderzoeksdoeleinden.
Alexander Vrancken meldt research support van Prinses Beatrix Spierfonds, ZonMW/ZE&GG en Pfizer, niet gerelateerd aan behandeling voor CIDP.
Referenties
Abbas, A., and Y. A. Rajabally. 2019. ‘Complications of Immunoglobulin Therapy and Implications for Treatment of Inflammatory Neuropathy: A Review’, Curr Drug Saf, 14: 3-13.
Allen, J. A., M. Berger, L. Querol, K. Kuitwaard, and R. D. Hadden. 2018. ‘Individualized immunoglobulin therapy in chronic immune-mediated peripheral neuropathies’, J Peripher Nerv Syst, 23: 78-87.
Dyck, P. J., W. J. Litchy, K. M. Kratz, G. A. Suarez, P. A. Low, A. A. Pineda, A. J. Windebank, J. L. Karnes, and P. C. O’Brien. 1994. ‘A plasma exchange versus immune globulin infusion trial in chronic inflammatory demyelinating polyradiculoneuropathy’, Ann Neurol, 36: 838-45.
Eftimov, Filip, John B. Winer, Marinus Vermeulen, Rob de Haan, and Ivo N. van Schaik. 2013. ‘Intravenous immunoglobulin for chronic inflammatory demyelinating polyradiculoneuropathy’, Cochrane Database of Systematic Reviews.
Gallia, F., C. Balducci, and E. Nobile-Orazio. 2016. ‘Efficacy and tolerability of different brands of intravenous immunoglobulin in the maintenance treatment of chronic immune-mediated neuropathies’, J Peripher Nerv Syst, 21: 82-4.
Hadden, R. D., and F. Marreno. 2015. ‘Switch from intravenous to subcutaneous immunoglobulin in CIDP and MMN: improved tolerability and patient satisfaction’, Ther Adv Neurol Disord, 8: 14-9.
Hughes, R., M. C. Dalakas, I. Merkies, N. Latov, J. M. Leger, E. Nobile-Orazio, G. Sobue, A. Genge, D. Cornblath, M. Merschhemke, C. M. Ervin, C. Agoropoulou, and H. P. Hartung. 2018. ‘Oral fingolimod for chronic inflammatory demyelinating polyradiculoneuropathy (FORCIDP Trial): a double-blind, multicentre, randomised controlled trial’, Lancet Neurol, 17: 689-98.
Hughes, Richard A. C., Peter Donofrio, Vera Bril, Marinos C. Dalakas, Chunqin Deng, Kim Hanna, Hans-Peter Hartung, Norman Latov, Ingemar S. J. Merkies, Pieter A. van Doorn, and I. C. E. Study Group. 2008. ‘Intravenous immune globulin (10% caprylate-chromatography purified) for the treatment of chronic inflammatory demyelinating polyradiculoneuropathy (ICE study): a randomised placebo-controlled trial’, The Lancet. Neurology, 7: 136-44.
Iijima, M., M. Yamamoto, M. Hirayama, F. Tanaka, M. Katsuno, K. Mori, H. Koike, N. Hattori, K. Arimura, M. Nakagawa, H. Yoshikawa, K. Hayasaka, O. Onodera, M. Baba, H. Yasuda, T. Saito, M. Nakazato, K. Nakashima, J. Kira, R. Kaji, N. Oka, and G. Sobue. 2005. ‘Clinical and electrophysiologic correlates of IVIg responsiveness in CIDP’, NEUROLOGY, 64: 1471-5.
Kapoor M, Spillane J, Englezou C, Sarri-Gonzalez S, Bell R, Rossor A, Manji H, Reilly MM, Lunn MP, Carr A. 2020. Thromboembolic risk with IVIg: Incidence and risk factors in patients with inflammatory neuropathy. Neurology Feb 11;94(6):e635-e638.
Kuitwaard, K., W. R. Fokkink, E. Brusse, Afje Vrancken, F. Eftimov, N. C. Notermans, A. J. van der Kooi, I. S. J. Merkies, B. C. Jacobs, and P. A. van Doorn. 2017. ‘Maintenance IV immunoglobulin treatment in chronic inflammatory demyelinating polyradiculoneuropathy’, J Peripher Nerv Syst, 22: 425-32.
Kuitwaard, K., A. F. Hahn, M. Vermeulen, S. L. Venance, and P. A. van Doorn. 2015. ‘Intravenous immunoglobulin response in treatment-naive chronic inflammatory demyelinating polyradiculoneuropathy’, J Neurol Neurosurg Psychiatry, 86: 1331-6.
Kuitwaard, K., L. H. van den Berg, M. Vermeulen, E. Brusse, E. A. Cats, A. J. van der Kooi, N. C. Notermans, W. L. van der Pol, I. N. van Schaik, S. I. van Nes, W. C. Hop, and P. A. van Doorn. 2010. ‘Randomised controlled trial comparing two different intravenous immunoglobulins in chronic inflammatory demyelinating polyradiculoneuropathy’, J Neurol Neurosurg Psychiatry, 81: 1374-9.
Kuitwaard, K., P. A. van Doorn, M. Vermeulen, L. H. van den Berg, E. Brusse, A. J. van der Kooi, W. L. van der Pol, I. N. van Schaik, N. Notermans, A. P. Tio-Gillen, W. van Rijs, T. van Gelder, and B. C. Jacobs. 2013. ‘Serum IgG levels in IV immunoglobulin treated chronic inflammatory demyelinating polyneuropathy’, J Neurol Neurosurg Psychiatry, 84: 859-61.
Kuitwaard K, Brusse E, Jacobs BC, Vrancken AFJE, Eftimov F, Notermans NC, van der Kooi AJ, Fokkink WR, Nieboer D, Lingsma HF, Merkies ISJ, van Doorn PA. 2021. Randomized trial of intravenous immunoglobulin maintenance treatment regimens in chronic inflammatory demyelinating polyradiculoneuropathy. Eur J Neu Jan;28(1):286-296.
Kuwabara, S., M. Mori, S. Misawa, M. Suzuki, K. Nishiyama, T. Mutoh, S. Doi, N. Kokubun, M. Kamijo, H. Yoshikawa, K. Abe, Y. Nishida, K. Okada, K. Sekiguchi, K. Sakamoto, S. Kusunoki, G. Sobue, and R. Kaji. 2017. ‘Intravenous immunoglobulin for maintenance treatment of chronic inflammatory demyelinating polyneuropathy: a multicentre, open-label, 52-week phase III trial’, J Neurol Neurosurg Psychiatry, 88: 832-38.
Latov, N., C. Deng, M. C. Dalakas, V. Bril, P. Donofrio, K. Hanna, H. P. Hartung, R. A. Hughes, I. S. Merkies, and P. A. van Doorn. 2010. ‘Timing and course of clinical response to intravenous immunoglobulin in chronic inflammatory demyelinating polyradiculoneuropathy’, Arch Neurol, 67: 802-7.
Lunn, M. P., L. Ellis, R. D. Hadden, Y. A. Rajabally, J. B. Winer, and M. M. Reilly. 2016. ‘A proposed dosing algorithm for the individualized dosing of human immunoglobulin in chronic inflammatory neuropathies’, J Peripher Nerv Syst, 21: 33-7.
Markvardsen, L. H., and T. Harbo. 2017. ‘Subcutaneous immunoglobulin treatment in CIDP and MMN. Efficacy, treatment satisfaction and costs’, J Neurol Sci, 378: 19-25.
Mielke, O., V. Bril, D. R. Cornblath, J. P. Lawo, N. van Geloven, H. P. Hartung, R. A. Lewis, I. S. J. Merkies, G. Sobue, B. Durn, A. Shebl, and I. N. van Schaik. 2019. ‘Restabilization treatment after intravenous immunoglobulin withdrawal in chronic inflammatory demyelinating polyneuropathy: Results from the pre-randomization phase of the Polyneuropathy And Treatment with Hizentra study’, J Peripher Nerv Syst, 24: 72-79.
Rajabally, Y. A., H. Seow, and P. Wilson. 2006. ‘Dose of intravenous immunoglobulins in chronic inflammatory demyelinating polyneuropathy’, J Peripher Nerv Syst, 11: 325-9.
Rajabally, Y. A., S. L. Wong, and D. A. Kearney. 2013. ‘Immunoglobulin G level variations in treated chronic inflammatory demyelinating polyneuropathy: clues for future treatment regimens?’, J Neurol, 260: 2052-6.
RMC study groupo. 2009. ‘Randomised controlled trial of methotrexate for chronic inflammatory demyelinating polyradiculoneuropathy (RMC trial): a pilot, multicentre study’, Lancet Neurology, 8: 158-64.
van den Bergh PYK, van Doorn PA, Hadden RDM, Avau B, Vankrunkelsven P, Allen JA, Attarian S, Blomkwist PH, Cornblath DR, Eftimov F, Goedee HS, Harbo T, Kuwabara S, Lewis RA, Lunn MP, Nobile-Orazio E, Querol L, Rajabally YA, Sommer C, Topaloglu HA. European Academy of Neurology/Peripheral Nerve Society Guideline on diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy: Report of a joint Task Force – Second Revision. J Peripher Nerv Syst. 2021 Jun 4. doi: 10.1111/jns.12455
van Doorn, P. A., M. Vermeulen, A. Brand, P. G. Mulder, and H. F. Busch. 1991. ‘Intravenous immunoglobulin treatment in patients with chronic inflammatory demyelinating polyneuropathy. Clinical and laboratory characteristics associated with improvement’, Arch Neurol, 48: 217-20.
van Schaik, I. N., V. Bril, N. van Geloven, H. P. Hartung, R. A. Lewis, G. Sobue, J. P. Lawo, M. Praus, O. Mielke, B. L. Durn, D. R. Cornblath, and I. S. J. Merkies. 2018. ‘Subcutaneous immunoglobulin for maintenance treatment in chronic inflammatory demyelinating polyneuropathy (PATH): a randomised, double-blind, placebo-controlled, phase 3 trial’, Lancet Neurol, 17: 35-46.